弱化学键|可燃化学品中隐藏的能量
今年8月4日是贝鲁特大爆炸(这是有记录以来规模最大、破坏性最强的工业事故之一)的周年,我们应当铭记这场悲剧——这场爆炸的巨大声响在200公里外的塞浦路斯都能听到。爆炸的震中位于港口仓库,而爆炸的燃料是存放在仓库中的2,750吨硝酸铵。
硝酸铵是使用最广泛的肥料之一,它是许多其它工业化合物(如采矿炸药)的重要成分,并被用作生产抗生素和酵母的营养物质。与工业过程中使用的许多其它化学品一样,通过安全储存和可靠的处理程序来降低可以降低它带来的风险。
据认为,贝鲁特爆炸是因为港口的一个仓库起火并蔓延至储存硝酸铵的区域;同时附近烟花的不安全存放、没有隔离或防火措施都导致了大爆炸的发生。在几秒钟内,这一事故造成200多人死亡、5,000多人受伤,并使大约300,000名居民无家可归。可悲的是,这并不是唯一发生的事故,由硝酸铵等化学物质引起的爆炸和火灾曾多次发生。归根结底,如果一种物质可以快速释放能量,那么它就有潜在的发生爆炸或火灾的风险。但是为什么某些化学品会具有这些特性呢?

弱化学键和稳定产物共同带来爆炸危险
如果一种物质的化学键较弱,特别是如果它能产生稳定的产物,则很可能会带来火灾或爆炸的危险。燃料(如汽油)燃烧是因为它们的燃烧过程会产生具有更强化学键的稳定物质;就汽油而言,它的燃烧产物是二氧化碳和水。汽油需要热源或点火源(如火花或火焰)才能燃烧,因为燃料反应物中的键不容易断裂。
例如,图1显示了反应(如:汽油燃烧)的概念模型。紫色线显示了在从反应物到产物的反应过程中,自由能是如何变化的。汽油燃烧时,会形成含有强化学键的稳定产物(水和二氧化碳),并在燃烧过程中释放出大量能量。这在图中通过从左侧起始点到右侧反应结束点的高度差来显示。随着反应物和产物之间自由能差的增加,反应发生时可释放的能量也在增加。
然而,为了从反应物生成产物,分子必须有足够的能量来启动反应。反应通常从键的断裂开始,而强键则需要大量能量才能断裂。因此,要启动一个稳定分子的反应,必须为反应提供大量的能量。这种能量被称为活化位垒(activation barrier),由反应路径中间小山的高度表示。
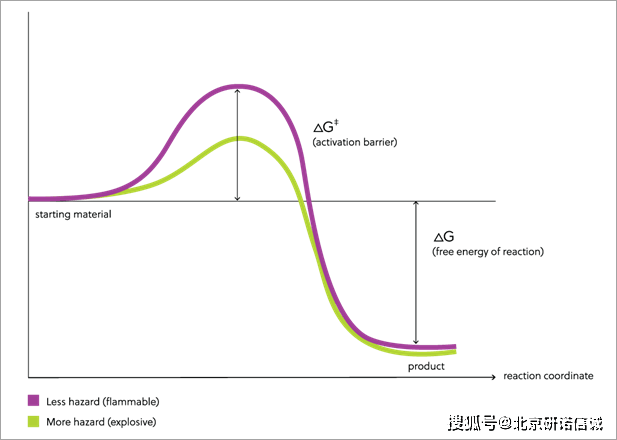 图1. 活化位垒与反应能的比较
图1. 活化位垒与反应能的比较
一旦突破活化位垒,反应就会发生。由于反应物和产物之间的自由能差很大,一个分子的反应可以提供足够的能量帮助其它分子克服活化位垒。然后反应会加速,并且,在反应物被消耗掉之前难以停止。因此,一旦汽油起火,就很难被扑灭。此外,由于产物是气态的(二氧化碳和蒸汽),所以产物会比反应物占据更多的空间。而体积的膨胀会将能量传递到周围;如果反应发生在密闭空间内,则可能会引起爆炸。不过,由于汽油燃烧需要更多能量,因此更易避免提供该能量的行为,从而更利于防止火灾。
其它许多含有弱化学键的物质则会带来更大的危害。图1中绿线显示了一个包含弱化学键的分子的燃烧反应模型。像汽油一样,左边的反应物和右边的产物之间的自由能差(如高度差所示)很大;产物中含有强键,反应发生时会释放大量能量。然而,该反应的活化位垒高度远低于汽油燃烧的位垒。
反应通常从键的断裂开始,弱化学键的存在为反应启动提供了一个容易的起始点。一旦键发生断裂,反应就可以完成。当产物的能量远低于反应物的能量时(如图1中绿线代表的物质反应),一个分子的反应可以释放能量以开始其它分子的反应;由于反应的活化位垒较低,与图1中紫线的反应相比,绿线的反应中一个分子发生反应所释放的能量可以引起更多分子发生反应。弱键的存在意味着反应一旦开始,就会迅速加速。如果产物是气体,它们也会向周围扩散;如果反应足够快,就会发生爆炸。含有弱化学键的物质的反应活化位垒越低,意味着启动反应所需的能量越少,因此安全搬运含有弱化学键的物质的方式就更加受限。在某些情况下,搬运产生的冲击、摩擦或火花会引发反应,因此搬运此类物质需要更加小心,以防止火灾或爆炸的发生。
叠氮化物(RN3)非常好地诠释了这一点。叠氮化物包含三个相连的氮原子,氮原子间键的强度不等。氮原子可以形成强键——氮气分子(N2)中的氮原子之间的三键是已知最强的化学键之一;然而,氮原子也可以形成相当弱的单键和双键。叠氮化物中的一个氮-氮键很弱,不需要太多能量即可断裂,从而促使其快速分解生成N2。因为N2中的氮-氮键比反应物叠氮化物中的氮-氮键稳定得多,所以这种分解会释放大量能量。
无机和有机叠氮化物具有不同的反应灵敏度。无机叠氮化钠可以在日常条件下安全处理,但在汽车安全气囊中被用作快速气体发生器;而高挥发性重金属叠氮化物,如叠氮化铅,则被用作炸药的引发剂。有机叠氮化物通常用于合成更复杂的化学品,包括药物和聚合物。具有低分子量或高氮(N)碳(C)原子比的有机叠氮化合物可能具有爆炸性,已报道过几起实验室爆炸事件,是由于无机叠氮化合物与二氯甲烷反应形成低分子量叠氮化合物而引发。用于制备修饰蛋白质的叠氮化物修饰氨基酸也被发现具有爆炸性。
过氧化物(ROOR)是另一类具有潜在爆炸特性的分子。过氧化物含有弱氧-氧单键;当这些氧-氧单键发生断裂时,过氧化物会产生可用于化学反应的自由基中间体(自由基)。自由基中间体对于引发聚合反应特别有效,并通常被检测为燃烧过程的中间体;即使是少量的自由基也可以作为催化剂,并且在某些情况下,自由基会催化自身的形成。过氧化物也会分解成分子氧(O2);氧-氧单键弱,而O2中的氧-氧双键强,所以这种分解能够释放能量。
过氧化物含有弱氧-氧单键意味着它很容易分解,释放自由基和O2,这是一种易挥发的爆炸性组合,特别是在高浓度下更易发生爆炸。据报道,使用过氧化物的化学设施发生过几起重大火灾,其中包括美国德克萨斯州的一起火灾,当时飓风哈维和前所未有的洪水导致安全防护机制失效。过氧化物也可以在醚与氧接触时自发形成。这些过氧化物形成的晶体在受到物理冲击、摩擦或与某些金属反应时会发生爆炸。醚通常与少量抑制剂如 BHT(丁基羟基甲苯,用作防腐剂)一起配制,以防止形成过氧化物。抑制剂会被氧气消耗;如果醚在有氧的条件下长期保存,醚将易于形成过氧化物。
强烈趋向稳定
还有一些其它物质含有自身不易断裂的键,但在特定条件下易于发生反应,生成更稳定的产物。随着新键的生成,能量作为热量释放出来,会导致火灾或爆炸的发生。例如:金属烷基化合物被用作合成多种化学品和材料的催化剂,但它们通常在与空气接触时容易燃烧而发生自燃。
特别是三甲基铝,会与空气或水发生反应,生成具有高度稳定的铝氧键的产物,导致火灾和爆炸发生。
丙烯酸酯用于工业规模的聚合反应;每个丙烯酸酯单体在被结合到聚合物链上时,都会用一个新的单键取代它的双键。这种新的键比双键的累积强度更强,因此聚合反应释放能量。丙烯酸酯和其它烯烃的聚合通常利用自由基引发剂(如过氧化物的在其它情况下导致爆炸的相同反应性),来启动聚合反应。在大型聚合反应中,当表面积与体积之比太低而无法散发所生成的热量时,并且当不受控制的聚合反应的抑制剂被消耗、失活或去除时,丙烯酸酯就会发生爆炸性聚合。
同样,二甲基亚砜(DMSO)等溶剂可与酸、碱、亲电试剂等多种物质发生反应,来降低分解反应的温度;但是,即使在看似安全的较低温度下发生反应,仍可能导致爆炸。

现代世界的伟大推动者
能量变化使化学推动现代世界的进步成为可能,几个世纪以来,人类利用化学能量周游世界、推动工业发展、生产食物、衣服,以及我们日常生活中的织物。我们渴望获得爆炸性和挥发性化学物质的能量,但它们的能量也可能会产生意想不到的破坏性后果。通过了解如何以建设性的方式引导这种能量,并更好地了解化学物质意想不到的、有害的方式反应的条件,我们就可以在爆炸事故发生之前预测它们,并学会预防爆炸事故的发生。
